我校丁一教授团队揭示了肠道微生物通过类胰岛素样生长因子-1促进仔猪生长调节的机制
(通讯员 马宁)近日,华中农业大学动物医学院丁一教授团队在Microbiome上发表了题为“Gut-derived IL-13 contributes to growth via promoting hepatic IGF-1 production”的研究论文。为了寻找促进动物生长的有效方法,丁一教授团队以肠-肝轴为切入点,探寻动物生长的肠源调节因子,首次阐述了肠源细胞因子IL-13参与动物早期生长调节的机制。该研究不仅为人们理解肠道微菌群与宿主免疫和代谢互作提供了新的视角,而且为最大限度发挥动物生长的遗传潜能和解决人类代谢异常(如营养不良、生长迟缓、肌少症、肥胖)或相关疾病提供了新的干预途径。
肠道微生物对宿主免疫和代谢产生巨大影响,但三者相互作用的机制至今未被完全阐明清楚。出生后的生长受生长激素轴(GH/IGF-1)的调节,即腺垂体分泌的生长激素(GH)主要诱导肝脏类胰岛素生长因子(IGF-1)合成,后者通过血液循环被转运至其他组织,增加机体合成代谢。丁一教授团队研究发现,在饲料中添加低水平抗菌剂(SLA)后仔猪肠道微生物群结构发生改变,肝脏中IGF-1显著升高,但循环血液中GH无显著变化(图1),由此推测其肠道微生物群的改变可能通过某种(些)肠源“活性物质”经汇集肠道血液的门脉循环递送至肝脏,诱导肝细胞IGF-1的产生。根据这一假设,该团队进一步研究发现SLA引起肠道普氏菌(Prevotella_copri)的富集,诱导肠道免疫由CD4+细胞亚群向Th2细胞亚群的表型转换,导致细胞因子IL-13在门脉血液中升高(图2)。随后,研究揭示这种肠源IL-13通过激活肝细胞IL-13受体-Jak2-Jak6信号通路而刺激IGF-1的合成,增加肌纤维的合成与分化,改善机体生长表型。肠源IL-13的促生长作用在幼龄小鼠体内也得到了了验证,证实了其具有跨种特性。
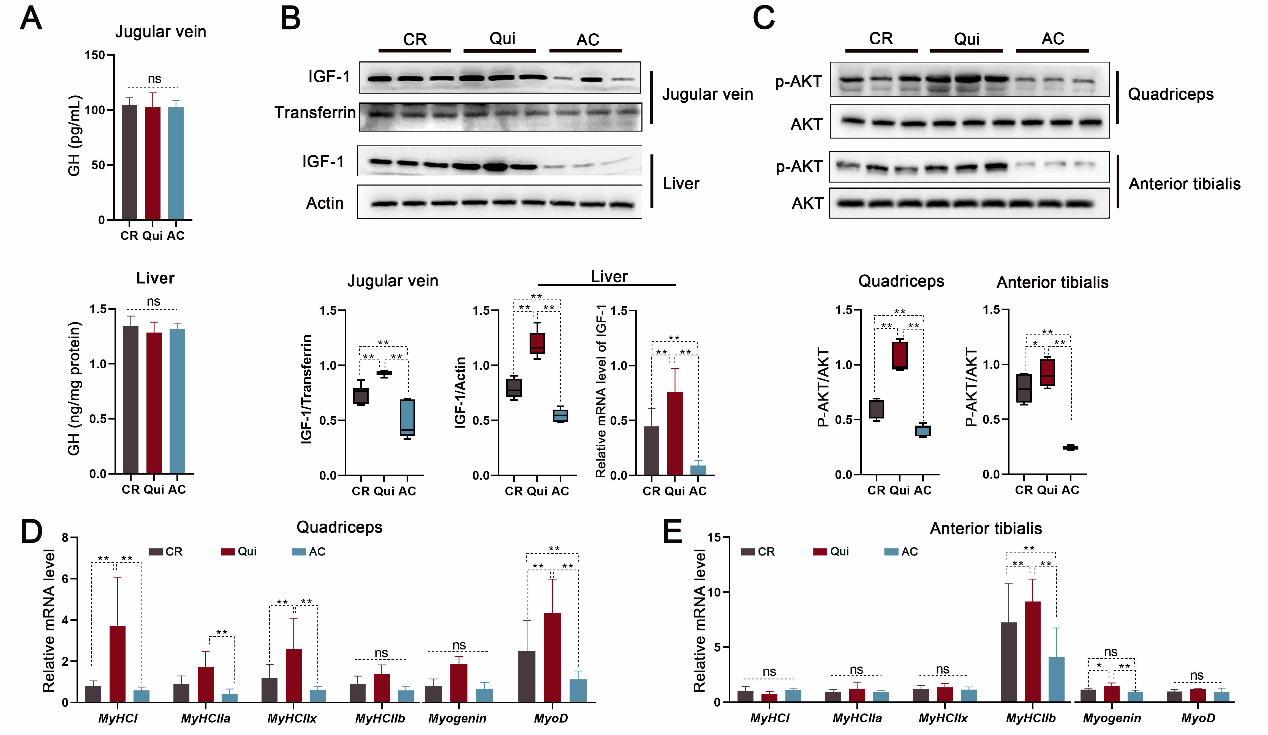
图1 低水平抗菌剂促使仔猪肝脏中IGF-1升高
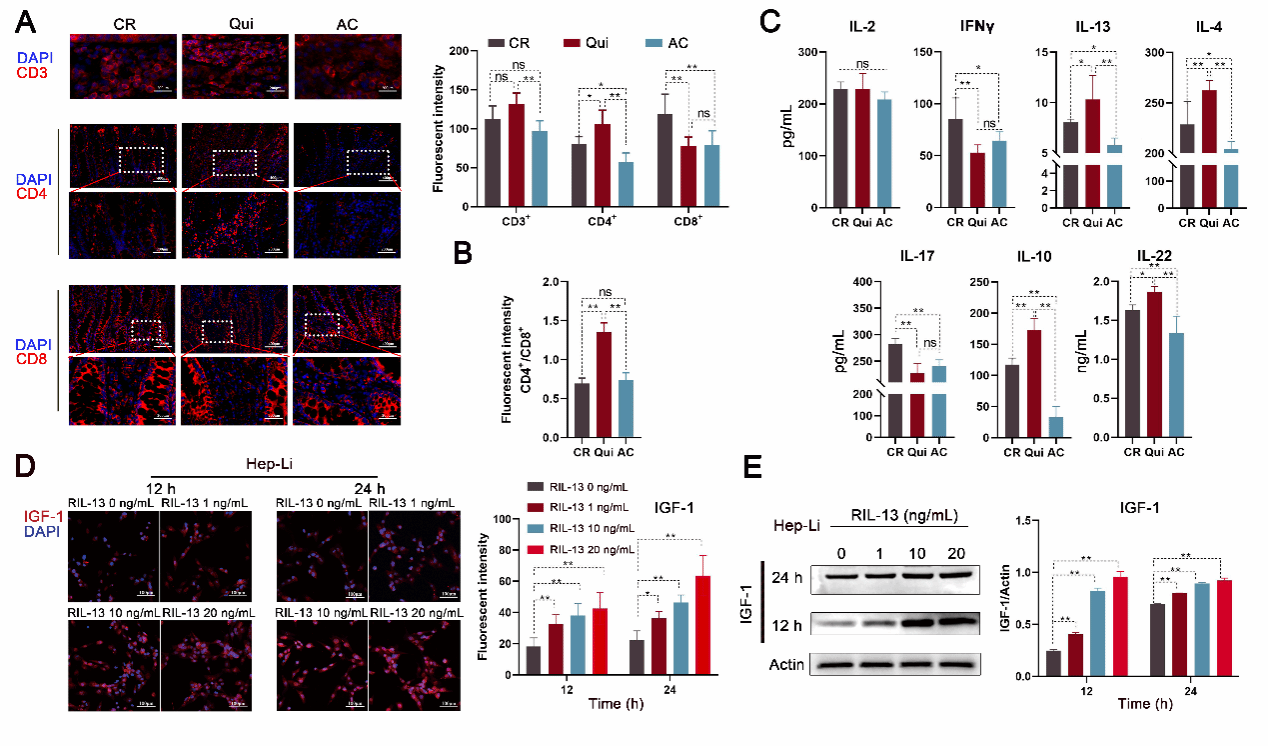
图2肠道菌群诱导仔猪肠道免疫由CD4+细胞亚群向Th2细胞亚群的表型转换和门脉血液中IL-13水平升高
肠道定居的微生物调节宿主的先天性和适应性免疫。传统观点认为免疫系统的激活通过细胞因子作用于生长激素轴增加能量消耗,抑制合成代谢,促使用于组织生长的营养以支持增强的免疫活动。然而,丁一团队的研究发现颠覆了这一观念,即特定的肠道免疫刺激还可通过多能免疫细胞因子促进机体的合成代谢(图3)。该团队研究表明,靶向调节肠道微生物,改变肠道的免疫状态,可能是调节宿主合成代谢的重要策略。在倡导绿色健康养殖理念的当下,该研究揭示了肠道微生物群与宿主免疫和代谢互作调节的奥秘,开辟了挖掘动物遗传生长潜力的新途径,对提高动物养殖增效具有重要的意义。
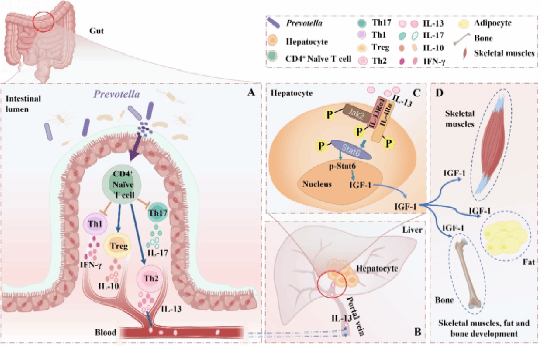
图3肠源IL-13通过诱导肝脏中IGF-1的产生进而促动物早期生长
华中农业大学动物医学院已毕业博士马宁为论文第一作者,丁一教授为通讯作者。本研究受到国家自然科学基金和中央高校基本科研业务费专项资金等项目资助。
审核人 丁一
【文章链接】:
https://microbioejournal.biomedcentral.com/articles/10.1186/s40168-024-01929-3

